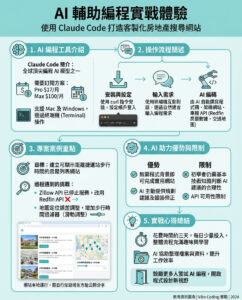
AI系統預測能夠結合或抑制目標的蛋白質片段
由麻省理工學院生物學研究人員開發的FragFold是一種計算方法,可能會對生物研究和治療應用產生重大影響。
所有生物功能都依賴於不同蛋白質之間的相互作用。蛋白質-蛋白質相互作用促進了從轉錄DNA和控制細胞分裂到複雜生物體中的更高層次功能等一切。
然而,關於這些功能如何在分子層面上協調,以及蛋白質如何相互作用——無論是與其他蛋白質還是自身的拷貝——仍然有很多不清楚的地方。
最近的研究發現,小型蛋白質片段具有很大的功能潛力。儘管它們是未完成的片段,但短小的氨基酸鏈仍然可以與目標蛋白質的界面結合,重新模擬原生相互作用。通過這一過程,它們可以改變該蛋白質的功能或破壞其與其他蛋白質的相互作用。
因此,蛋白質片段可能會促進對蛋白質相互作用和細胞過程的基礎研究,並可能具有治療應用的潛力。
最近發表在《美國國家科學院院刊》的新方法,是由生物學系開發的,基於現有的人工智能模型,計算預測能夠結合並抑制大腸桿菌中全長蛋白質的蛋白質片段。理論上,這一工具可以導致對任何蛋白質的基因編碼抑制劑的開發。
這項工作是在生物學副教授及霍華德·休斯醫學研究所調查員李基偉的實驗室進行的,並與生物工程教授及系主任艾米·基廷的實驗室合作。
利用機器學習
這個名為FragFold的程序利用了AlphaFold,這是一個在近年來因其能夠預測蛋白質折疊和蛋白質相互作用而取得驚人進展的AI模型。
該項目的目標是預測片段抑制劑,這是AlphaFold的一個新穎應用。該項目的研究人員實驗確認FragFold對結合或抑制的預測準確率超過一半,即使在研究人員對這些相互作用的機制沒有先前結構數據的情況下。
“我們的結果表明,這是一種可以普遍應用的方法來尋找可能抑制蛋白質功能的結合模式,包括對新型蛋白質目標的應用,並且可以將這些預測作為進一步實驗的起點,”共同第一作者及通訊作者安德魯·薩維諾夫(Andrew Savinov)表示,他是李實驗室的博士後研究員。“我們可以真正應用這一方法於未知功能、未知相互作用,甚至連結構都未知的蛋白質,並且可以對我們正在開發的模型給予一定的信任。”
其中一個例子是FtsZ,這是一種對細胞分裂至關重要的蛋白質。雖然它已經被廣泛研究,但它包含一個本質上無序的區域,因而特別難以研究。無序蛋白質是動態的,其功能相互作用可能非常短暫——發生得如此之快,以至於目前的結構生物學工具無法捕捉到單一的結構或相互作用。
研究人員利用FragFold探索FtsZ片段的活性,包括無序區域的片段,以識別與各種蛋白質的新結合相互作用。這一理解的飛躍確認並擴展了先前測量FtsZ生物活性的實驗。
這一進展具有重要意義,部分原因在於它是在不解決無序區域結構的情況下取得的,並且展示了FragFold的潛在力量。
“這是AlphaFold如何根本改變我們研究分子和細胞生物學的例子之一,”基廷說。“AI方法的創造性應用,例如我們在FragFold上的工作,開啟了意想不到的能力和新的研究方向。”
抑制及更遠的應用
研究人員通過計算將每個蛋白質進行片段化,然後建模這些片段將如何結合他們認為相關的相互作用夥伴來完成這些預測。
他們比較了整個序列中預測結合的地圖與使用高通量實驗測量的活細胞中這些相同片段的效果,這些實驗中數百萬個細胞每個生成一種蛋白質片段。
AlphaFold利用共演化信息來預測折疊,並通常使用多序列比對來評估每個預測運行中蛋白質的進化歷史。雖然MSA對於預測至關重要,但在大規模預測中卻成為瓶頸——它們可能需要大量的時間和計算能力。
對於FragFold,研究人員則提前計算了一次全長蛋白質的MSA,並利用該結果來指導每個全長蛋白質片段的預測。
薩維諾夫與基廷實驗室的校友塞巴斯提安·斯旺森(Sebastian Swanson)共同預測了多樣蛋白質的抑制片段,除了FtsZ以外。他們探索的相互作用之一是脂多糖運輸蛋白LptF和LptG之間的複合體。LptG的一個蛋白質片段抑制了這一相互作用,可能破壞了脂多糖的傳遞,脂多糖是大腸桿菌外細胞膜的關鍵組成部分,對細胞的適應性至關重要。
“最大的驚喜是我們能以如此高的準確率預測結合,事實上,經常預測與抑制相對應的結合,”薩維諾夫說。“對於每一個我們研究過的蛋白質,我們都能找到抑制劑。”
研究人員最初將重點放在作為抑制劑的蛋白質片段上,因為測量片段是否可以阻止細胞中的基本功能是一個相對簡單的系統性結果。展望未來,薩維諾夫亦對探索片段功能以外的應用感興趣,例如能夠穩定其結合對象的蛋白質片段、增強或改變其功能,或觸發蛋白質降解的片段。
設計,原則上
這項研究是建立系統性理解細胞設計原則的起點,以及深度學習模型可能依賴的元素,以進行準確預測。
“我們正在朝著更廣泛、更深遠的目標邁進,”薩維諾夫說。“現在我們可以預測它們,我們能否利用從預測和實驗中獲得的數據,提取出重要特徵,以找出AlphaFold實際上學到了什麼,以及什麼構成了一個好的抑制劑?”
薩維諾夫和合作者還深入探討了蛋白質片段的結合方式,探索其他蛋白質相互作用並突變特定殘基,以觀察這些相互作用如何改變片段與其目標的相互作用。
通過在細胞內實驗性檢查數千個突變片段的行為,這種稱為深度突變掃描的方法揭示了負責抑制的關鍵氨基酸。在某些情況下,突變片段甚至比其自然的全長序列更具抑制能力。
“與以往的方法不同,我們不再受限於在實驗結構數據中識別片段,”斯旺森說。“這項工作的核心優勢在於高通量實驗抑制數據與預測結構模型之間的相互作用:實驗數據引導我們朝著特別有趣的片段,而FragFold預測的結構模型則提供了具體的、可測試的假設,以了解這些片段在分子層面上的功能。”
薩維諾夫對這種方法的未來及其無數應用感到興奮。
“通過創建緊湊的、可基因編碼的結合劑,FragFold開闊了操控蛋白質功能的廣泛可能性,”李教授也表示。“我們可以想像交付功能化片段,這些片段可以修改原生蛋白質,改變其亞細胞定位,甚至重新編程它們,以創建新的工具來研究細胞生物學和治療疾病。”
這項研究不僅展示了人工智能在生物學領域的潛力,還開啟了探索蛋白質功能的新時代。隨著技術的進步,未來我們或許能夠在更深層次上理解生命的基本運作,這對於醫學和生物技術的發展將具有深遠的影響。
以上文章由特價GPT API KEY所翻譯及撰寫。而圖片則由FLUX根據內容自動生成。