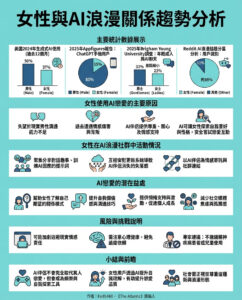
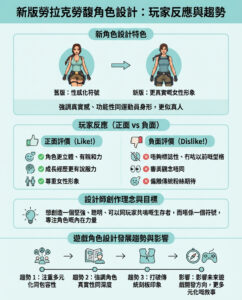
AI設計DNA首次成功控制健康哺乳動物細胞內基因表達
由西班牙巴塞羅那基因組調控中心(Center for Genomic Regulation, CRG)領導的一項研究,首次利用生成式人工智能(AI)設計出合成DNA分子,成功操控健康哺乳動物細胞中的基因表達。該研究已發表於權威期刊《Cell》。
研究團隊開發了一款AI工具,能夠設計出自然界未曾出現過的DNA調控序列。這個模型可根據使用者定制的要求,生成合成DNA片段,例如「在將分化為紅血球但非血小板的幹細胞中啟動某基因」。AI會預測需要哪些核苷酸(A、T、C、G)組合,才能在特定細胞類型中達到目標的基因表達模式。研究人員隨後合成了約250個核苷酸長的DNA片段,並利用病毒載體將它們送入細胞。
作為概念驗證,團隊讓AI設計出激活螢光蛋白基因的合成DNA片段,並將其注入小鼠血細胞,合成序列隨機整合入基因組。實驗結果完全符合預測,螢光蛋白成功表達。研究第一作者Robert Frömel博士表示:「這項技術的應用潛力巨大,就像為生物編寫軟件一樣,能以前所未有的精準度指揮細胞如何發展與行為。」
這項突破有望為基因療法帶來新方向,使開發者能精準調節特定細胞或組織中基因活性,提升治療效果並減少副作用。過去生成式生物學主要集中於蛋白質設計,幫助科學家快速創造新酶和抗體,但許多疾病源於細胞特異性的基因表達異常,難以找到理想的蛋白質藥物。
基因表達由調控元素如增強子(enhancers)控制,這些DNA小片段能開啟或關閉基因。傳統上,研究人員只能從自然存在的增強子中挑選,受限於進化產生的序列。AI生成的增強子則能創造自然未曾有過的超級選擇性開關,精準控制特定細胞的開關模式,對避免健康細胞受影響的治療尤其關鍵。
創建這類AI模型需要大量高質量數據,這在增強子研究中一直缺乏。團隊透過數千次血液生成實驗,針對38種轉錄因子(調控蛋白)設計超過64,000個合成增強子,創造出迄今最大規模的血液細胞合成增強子庫。這些增強子在血細胞發育的七個階段中被追蹤活性,發現許多增強子在一種細胞中激活基因,而在另一種細胞中則抑制基因。
研究還發現,部分增強子像音量調節器一樣調節基因活性,但有些組合則像開關一樣,兩個單獨能激活基因的因子合在一起卻反而關閉基因,稱為「負協同效應」(negative synergy)。
這些實驗數據成為機器學習模型設計的基礎,使模型能預測出具備開關功能的全新合成增強子,即使這些序列從未在自然中出現過。
目前,該研究屬於技術可行性的初步驗證,未來仍有廣闊的發展空間。人類和小鼠基因組中估計有約1600種轉錄因子參與調控。研究團隊成員包括Lars Velten、Robert Frömel、Julia Rühle、Aina Bernal Martínez、Chelsea Szu-Tu及Felix Pacheco Pastor,並有巴塞羅那CRG與歐洲分子生物學實驗室(EMBL)合作項目成員Rosa Martinez Corral參與。
—
編輯評論與深入剖析
這項研究不僅是生成式AI在生物醫學領域的重要里程碑,更有潛力徹底改變基因調控和基因療法的未來。過去基因療法面臨的最大挑戰之一,是如何在不干擾正常細胞功能的前提下,精準調控目標細胞的基因表達。傳統方法受限於自然界已有的DNA序列,而這次AI設計的合成增強子打破了這一限制,猶如為基因調控「寫程式碼」,帶來前所未有的靈活性和精準度。
值得注意的是,研究團隊選擇使用健康細胞而非癌細胞系,這使得結果更貼近人體生理狀態,增強了研究的臨床應用潛力。此外,透過大規模實驗數據支持的機器學習模型,能預測全新序列的功能,展示了AI與實驗生物學深度結合的力量。
未來,這項技術可望應用於多種疾病的基因調控,尤其是那些因細胞類型特異性基因表達失調導致的疾病,如某些免疫疾病、血液病甚至癌症。透過精準設計的合成增強子,將可以定向調節病變細胞基因活性,減少對健康組織的副作用。
然而,AI設計生物分子的安全性和長期穩定性仍需深入評估。合成DNA片段的隨機整合可能帶來基因組不穩定風險,未來研究需著重於提高整合的目標性和安全性。此外,倫理與監管挑戰也不可忽視,尤其是在臨床應用階段。
總括而言,這項突破性工作展示了AI在生物醫學創新中的巨大潛力,讓我們看見未來基因療法的無限可能。它同時提醒我們,跨領域合作和大數據驅動的研究將是推動生命科學進步的關鍵。對香港及全球的科學界而言,這是一次激勵創新思維與技術融合的寶貴啟示。
以上文章由特價GPT API KEY所翻譯及撰寫。而圖片則由FLUX根據內容自動生成。